什么是医疗器械主文档制度
医疗器械主文档制度是医疗器械监管中一项重要的技术文件提交机制,该资料是由其所有者向医疗器械监管机构提交包含关键技术参数的保密性文件,用于授权医疗器械产品申请人在申报医疗器械注册等事项时使用。
主文档制度的国内外发展差异化
纵观国外监管实践,医疗器械主文档制度呈现差异化发展态势。美国FDA器械与放射健康中心(CDRH)早在1997年就建立了相关管理规范,日本厚生省在2000年针对特定高分子材料发布了相关主文档通知,欧盟则在其指令中记录了关于药品主文档的相关要求。我国国家药监局自2018年启动相关研究以来,逐步建立起符合国情的医疗器械主文档登记体系,于2021年出台了《关于医疗器械主文档登记事项的公告》。
丝素蛋白主文档登记数量激增
医疗器械在疾病的预防、诊断、治疗和康复过程中发挥着不可替代的作用,其安全性和有效性直接关系到患者的生命健康。而医疗器械的性能很大程度上取决于所使用的原材料,因此原材料的选择至关重要。目前常见的医疗器械原材料包括金属材料(如钛合金、不锈钢)、高分子材料(如聚乙烯、聚氨酯)、陶瓷材料(如氧化锆)等。
近年来,随着生物材料研究的深入,丝素蛋白作为一种新型原材料崭露头角。这种从蚕丝中提取的天然蛋白具有优异的生物相容性、可降解性和机械性能,在创面修复、组织工程支架及药物递送系统等领域展现出独特优势。
随着丝素蛋白在医疗器械领域应用的研究深入,丝素蛋白主文档登记数量也显著增长。据国家药监局医疗器械技术审评中心网站数据显示,截至今年5月,登记在案的丝素蛋白主文档已达39项,涉及11家创新企业,这一发展态势充分印证了丝素蛋白材料在高端医疗器械领域的广阔应用前景。
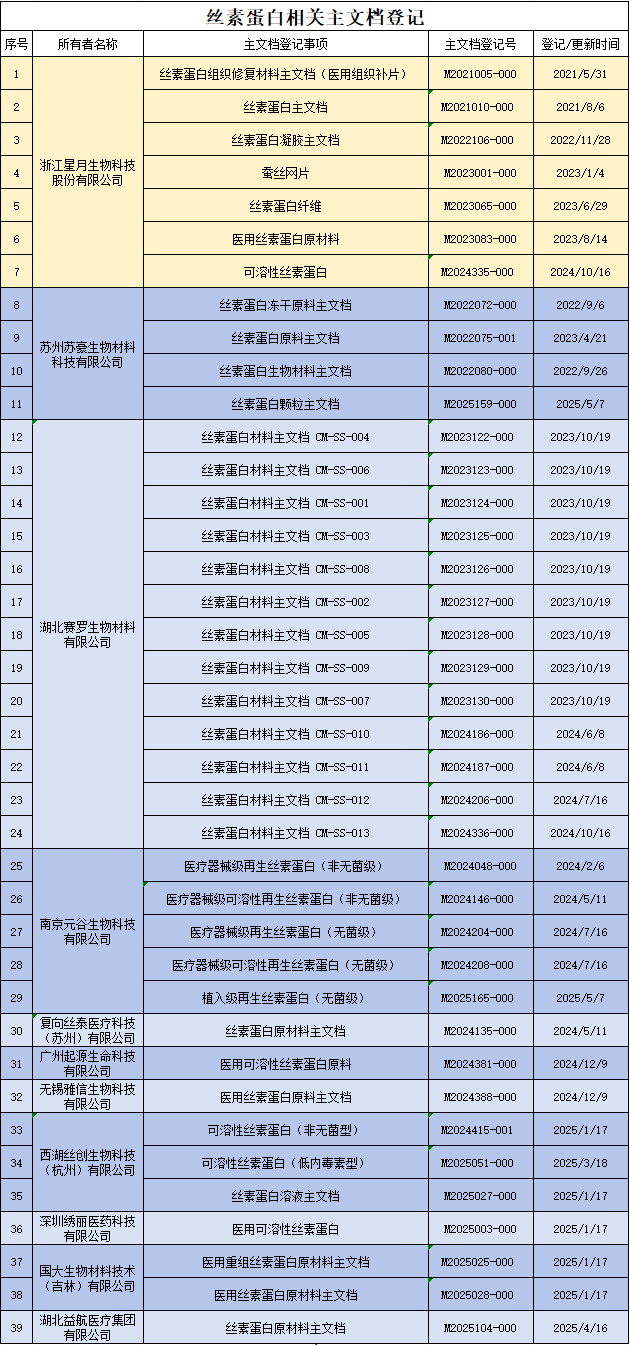
信息源于:CMED网站主文档登记信息公示
星月生物主文档登记的实践
星月生物深耕蚕丝材料领域二十年,通过持续创新,公司已拥有高纯丝素蛋白提取、分子重组、酶降解等核心技术,成功制备出纤维、粉末、溶液、海绵等多种形态的丝素蛋白原材料。自国家药监局推行主文档制度以来,星月生物率先在行业内开展丝素蛋白材料主文档登记工作,以系统性技术备案推动行业合规化发展。
2021年,星月生物完成国内首个丝素蛋白材料主文档登记—丝素蛋白组织修复材料主文档(医用组织补片),正式开启丝素蛋白原材料主文档登记的新征程。截至目前,公司已完成7项丝素蛋白核心材料的主文档登记,涵盖丝素蛋白凝胶、蚕丝网片、丝素蛋白纤维、可溶性丝素蛋白等多种原料类型。这些原料可广泛应用于细胞培养、组织工程、再生医学等前沿医疗领域,为医疗器械市场提供可溯源、安全性和创新性的原材料解决方案。

主文档制度的三重赋能
医疗器械主文档制度作为一项创新性监管机制,通过构建规范化的技术资料管理体系,在保障企业核心知识产权安全的同时,显著优化了医疗器械注册流程,为医疗器械行业带来了全方位的提升。
从企业层面看,显著降低了研发注册成本和时间消耗,使企业能够将更多资源投入到核心技术创新;从产业链看,促进了上下游企业的高效协同,减少了重复验证和审计环节,大幅缩短了产品注册周期,加速了产品上市进程;从行业生态看,推动了技术标准的统一和监管效率的提升,引导行业从低端仿制向高附加值创新转型。总体而言,医疗器械主文档制度不仅优化了单个产品的注册流程,更通过建立可持续的技术共享机制,为整个行业的高质量发展注入了新动能,实现了知识产权保护、产业效率提升和创新生态培育的多重目标。

